Glutation to główny antyoksydant komórek, który neutralizuje wolne rodniki i wiąże metale ciężkie. Działa jak lep na toksyny, ułatwiając ich unieszkodliwianie i usuwanie z organizmu. Jego poziom decyduje o tym, jak sprawnie radzimy sobie z obciążeniem oksydacyjnym.
Czym jest glutation i za co odpowiada w organizmie?
Glutation to niewielka cząsteczka z wielkim wpływem: własny, wbudowany w komórki antyoksydant, który pomaga neutralizować wolne rodniki i „sprzątać” toksyny. Działa głównie w wątrobie, ale obecny jest niemal wszędzie – w mózgu, płucach i mięśniach. Gdy jego poziom spada, komórki trudniej radzą sobie ze stresem oksydacyjnym, a to może odbijać się na energii, odporności i ostatecznie na tempie starzenia.
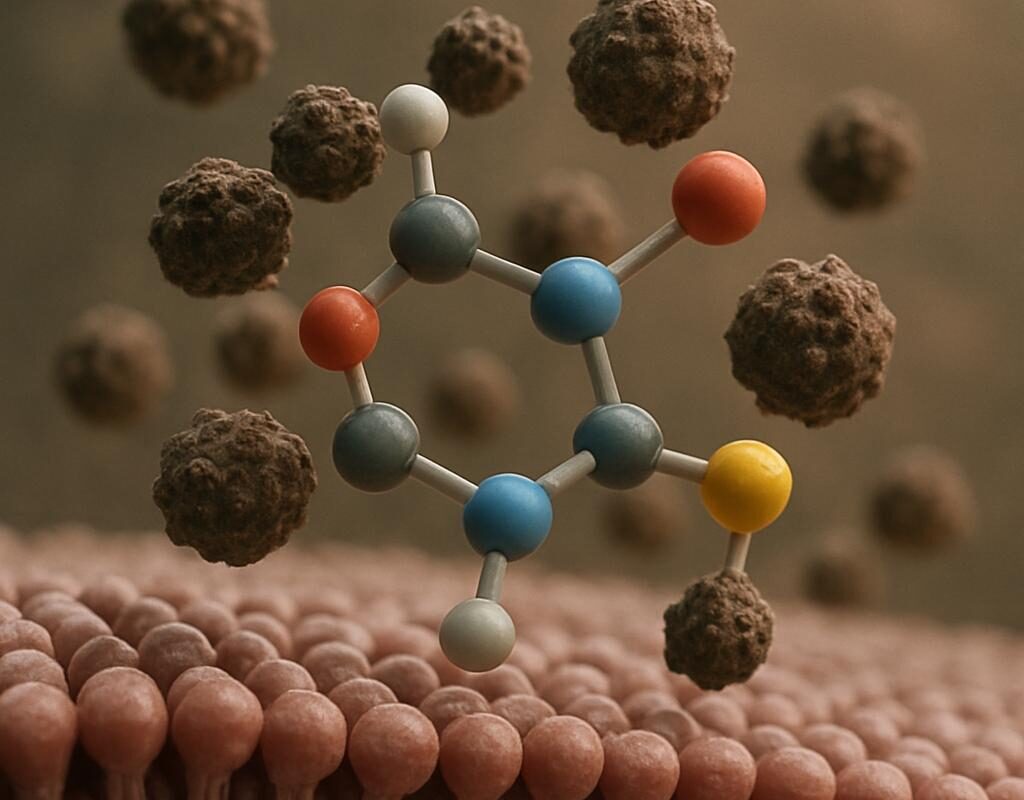
W ujęciu chemicznym glutation to tripeptyd, czyli krótki łańcuch trzech aminokwasów: glutaminianu, cysteiny i glicyny. Kluczowy jest atom siarki w cysteinie, który wiąże reaktywne cząsteczki i unieszkodliwia je w ułamku sekundy. W praktyce działa w dwóch „rolach”. Po pierwsze jako zmiatacz wolnych rodników reaktywnych form tlenu (ROS), chroniąc lipidy błon, białka i DNA. Po drugie jako kofaktor w enzymach, takich jak peroksydaza glutationowa i transferaza glutationowa, które w fazach II i III detoksykacji przekształcają ksenobiotyki (np. rozpuszczalne w tłuszczach pestycydy) w związki łatwiejsze do wydalenia z żółcią lub moczem.
Co istotne, glutation występuje w dwóch formach: zredukowanej GSH (aktywnej) i utlenionej GSSG. To stosunek GSH:GSSG stanowi czuły wskaźnik „czerwonego alarmu” w komórce. U osób zdrowych przeważa GSH, często w proporcji powyżej 9:1. Kiedy stres oksydacyjny rośnie, stosunek spada i pojawia się problem z regeneracją białek oraz recyklingiem innych przeciwutleniaczy, takich jak witamina C i E. Współpraca między nimi działa jak obieg zamknięty: glutation odzyskuje utlenioną witaminę C, a ta z kolei wspiera kolejne cząsteczki w łańcuchu obrony.
Organizm potrafi wytwarzać glutation samodzielnie, jednak proces zależy od dostępności substratów oraz energii. Najwęższym gardłem bywa cysteina; jej podaż, a także aktywność enzymu syntetazy gamma-glutamylocysteinowej, decydują o tempie syntezy. Na poziom wpływa też „zużycie” przez czynniki środowiskowe. Dym papierosowy, przewlekły stan zapalny czy intensywny kontakt z rozpuszczalnikami potrafią w ciągu godzin obniżać pulę GSH w tkankach. Z kolei sprawny recykling wymaga NADPH, czyli paliwa dostarczanego m.in. przez szlak pentozofosforanowy – dlatego kondycja mitochondriów i gospodarka glukozowa nie są tu drugorzędne.
Jak działa glutation jako “lep” na toksyny i wolne rodniki?
Glutation działa jak sprytny „lep”, bo przyłącza do siebie reaktywne cząsteczki i pomaga je bezpiecznie wyprowadzić z komórek. Robi to dwutorowo: neutralizuje wolne rodniki, oddając im elektron, oraz sprzęga toksyny, aby mogły zostać rozpuszczone w wodzie i wydalone z żółcią lub moczem. Kluczowe jest to, że działa wewnątrz komórek, zwłaszcza w wątrobie, gdzie stężenie glutationu należy do najwyższych w organizmie.
W chemii komórki glutation „pracuje” głównie w formie zredukowanej GSH. To ta postać oddaje elektron wolnemu rodnikowi i sama utlenia się do GSSG (dimer, czyli połączone dwie cząsteczki). Gdy stosunek GSH:GSSG utrzymuje się powyżej około 9:1, komórka ma korzystny potencjał redoks i lepiej radzi sobie ze stresem oksydacyjnym. Enzym reduktaza glutationowa, korzystając z NADPH, przekształca GSSG z powrotem w GSH, więc „lep” jest wielokrotnego użytku. Przy przeciążeniu toksynami lub niedoborze NADPH ten obieg zwalnia, co w badaniach bywa widoczne już w ciągu 24–48 godzin od silnego stresu oksydacyjnego.
Drugi mechanizm to sprzęganie (konjugacja) przez transferazy glutationowe. Glutation przyłącza się do elektrofilowych toksyn, np. epoksydów z dymu papierosowego czy metabolitów paracetamolu, czyniąc je mniej reaktywnymi i bardziej „wodnolubnymi”. Taki kompleks trafia do dalszego „obróbienia” i może zostać wydalony. W praktyce wspiera to trzy etapy detoksykacji wątroby: unieczynnienie reaktywnych metabolitów, ich rozpuszczanie i transport poza komórkę.
Co ciekawe, glutation nie działa w izolacji. Regeneruje się z pomocą witaminy C i enzymów wykorzystujących NADPH, a współpracuje też z innymi antyoksydantami, takimi jak tioredoksyna i koenzym Q10. Dzięki temu pojedyncza cząsteczka glutationu może uruchomić „łańcuszek” naprawczy, który ogranicza uszkodzenia błon komórkowych i DNA. Jeśli więc wyobrazić sobie kuchenną gąbkę, która chłonie rozlane mleko, to glutation jest taką gąbką, ale podłączoną do kranu z regeneracją — po odsączeniu znów nadaje się do pracy.
Skąd bierze się niedobór glutationu i jakie ma skutki?
Niedobór glutationu zwykle nie spada z nieba — narasta po cichu, gdy organizm ma zbyt dużo „sprzątania”, a za mało surowca i energii do produkcji. Zmniejszać poziom potrafią przewlekły stres, brak snu, dieta uboga w siarkę i białko, intensywny wysiłek bez regeneracji, a także kontakt z toksynami środowiskowymi. U wielu osób dochodzi do tego wiek: po 40.–50. roku życia endogenna synteza glutationu stopniowo słabnie. Swoje dokładają też infekcje, choroby przewlekłe i niektóre leki, które zwiększają produkcję wolnych rodników i „zużywają” zapasy.
Biochemicznie problem zaczyna się od braków w prekursorach, zwłaszcza w cysteinie (aminokwas siarkowy), oraz w kofaktorach takich jak selen i witaminy B6, B12 i foliany. Gdy ich brakuje, kluczowy enzym GCL (syntetaza gamma-glutamylocysteinowa) nie nadąża, a układ antyoksydacyjny przechyla się w stronę stresu oksydacyjnego. W praktyce może to oznaczać większą wrażliwość na dym, spaliny i alkohol, gorszą tolerancję wysiłku, częstsze „zjazdy” energii po południu oraz dłuższą rekonwalescencję po infekcjach.
- Skóra i błony śluzowe: częstsze podrażnienia, trudniej gojące się drobne rany, ziemisty koloryt przy ekspozycji na smog.
- Mięśnie i układ nerwowy: więcej zakwaszenia i mikrourazów po treningu, bóle głowy po 1–2 kieliszkach alkoholu.
- Wątroba i detoksykacja: gorsza tolerancja leków, nasilenie objawów po ekspozycji na rozpuszczalniki lub pestycydy.
- Odporność: częstsze przeziębienia w sezonie jesienno-zimowym i dłuższy czas powrotu do formy (o 1–3 dni).
- Starzenie komórkowe: szybsze oznaki stresu oksydacyjnego, co w badaniach wiąże się z pogorszeniem wydolności z wiekiem.
U części osób czynniki ryzyka są wrodzone. Polimorfizmy w genach GST i GCLC (enzymy sprzęgające i syntetyzujące glutation) obniżają „wydajność” układu i zwiększają zapotrzebowanie przy zwykłym trybie życia. Podobnie schorzenia jelit z upośledzonym wchłanianiem białka lub siarki oraz diety bardzo niskobiałkowe przez >8–12 tygodni mogą istotnie obniżać pulę glutationu. Dlatego przy przewlekłej męczliwości, nadwrażliwości na chemikalia lub nawracających infekcjach opłaca się spojrzeć na tło: sen, stres, jadłospis i ekspozycję środowiskową, a nie tylko na sam suplement.
Które produkty i nawyki wspierają naturalną produkcję glutationu?
Najprościej mówiąc: glutation rośnie, gdy organizm ma z czego go zbudować i ma energię, by to zrobić. Służą temu aminokwasy siarkowe (zwłaszcza cysteina), mikroelementy oraz spokojny metabolizm bez chronicznego stresu oksydacyjnego. Drobne zmiany w talerzu i trybie dnia potrafią podnieść własną produkcję glutationu w ciągu kilku tygodni, zamiast „gasić pożary” doraźną suplementacją.
W praktyce najbardziej liczy się codzienna powtarzalność. Z perspektywy kuchni działa to tak: im częściej lądują na talerzu produkty bogate w siarkę, antyoksydanty wspierające recykling glutationu oraz źródła selenu i cynku, tym stabilniejszy bywa poziom tego „lepu na toksyny”. Pomaga też unikanie zbędnego dymu papierosowego i nadmiaru alkoholu, bo obciążają wątrobę i przyspieszają zużycie glutationu. A jeśli dzień zaczyna się od szklanki wody i kończy 7–8-godzinnym snem, organizm ma lepsze warunki do odnowy zapasów w nocy.
Poniżej konkretne podpowiedzi, co łatwo wdrożyć przy planowaniu posiłków i codziennych nawyków.
- Warzywa krzyżowe (brokuł, jarmuż, kalafior) dostarczają związków siarkowych i sulforafanu; 1–2 porcje dziennie sprzyjają biosyntezie glutationu i aktywacji enzymów detoksykacyjnych.
- Czosnek i cebula są bogate w siarkę i prebiotyki; dodawane 4–5 razy w tygodniu wspierają produkcję cysteiny oraz zdrową mikrobiotę.
- Białko o dobrej jakości (jaja, rośliny strączkowe, ryby) dostarcza aminokwasów, z których powstaje glutation; przy 1–1,2 g białka/kg masy ciała zwykle nie brakuje „materiału budulcowego”.
- Produkty z selenem (orzechy brazylijskie, ryby morskie) wspierają enzym GPx, który korzysta z glutationu; 1–2 orzechy brazylijskie dziennie zwykle pokrywają zapotrzebowanie na selen.
- Witamina C i E z żywności (papryka, jagody, nasiona, oliwa) pomagają „odnawiać” glutation; kolorowe warzywa i garść orzechów dziennie tworzą prosty zestaw ochronny.
- Nawyki regenerujące: 7–9 godzin snu, 2–3 krótkie treningi tygodniowo i techniki obniżania stresu (np. 5 minut oddechu pudełkowego) zmniejszają zużycie glutationu przez stres oksydacyjny.
Uzupełnieniem bywa rozsądna higiena używek i smażenia. Mniej przetworzonych tłuszczów i dymu z patelni oznacza mniej aldehydów, z którymi glutation musi się zmierzyć. Tak buduje się środowisko, w którym ten antyoksydant może działać szybko i bez zbędnych strat.
Suplementacja glutationem: kiedy ma sens, a kiedy nie?
Krótko: suplementacja glutationem ma sens w sytuacjach zwiększonego obciążenia oksydacyjnego lub udokumentowanego niedoboru, ale nie zastąpi produkcji własnej. Najpierw bada się przyczynę, potem dobiera formę i dawkę, a na końcu monitoruje efekty.
W codziennej profilaktyce zwykle skuteczniejsze bywają prekursory, które „karmią” własną produkcję glutationu. Najlepiej przebadana jest N-acetylocysteina (NAC), która dostarcza cysteiny do syntezy GSH (aktywny glutation). W licznych badaniach stosowano 600–1200 mg NAC na dobę przez 4–12 tygodni, co podnosiło status antyoksydacyjny i bywało pomocne przy smogu czy infekcjach. Poza NAC pomaga selen w dawkach rzędu 55–100 µg, bo wspiera enzymy glutationowe, oraz kwas alfa-liponowy w zakresie 100–300 mg, który regeneruje zredukowaną formę GSH.
Bezpośredni glutation bywa użyteczny, ale forma ma znaczenie. Doustny GSH w klasycznej kapsułce słabo się wchłania, dlatego stosuje się liposomalne preparaty albo S-acetyl-L-glutathione. W praktyce używa się 100–500 mg na dobę przez 6–8 tygodni i ocenia, czy zmienia się poziom stresu oksydacyjnego lub objawy, które motywowały suplementację. Inhalacje i formy dożylne rezerwuje się dla wskazań medycznych, na przykład w przewlekłych chorobach płuc lub po chemioterapii, i wymagają one opieki lekarza.
Są też sytuacje, gdy dokładanie glutationu nie ma większego sensu. Jeśli dieta dostarcza białka 1,0–1,2 g/kg masy ciała, sen trwa 7–9 godzin, a obciążenie toksynami jest niskie, sam organizm zwykle utrzymuje prawidłowe stężenia. Ostrożność jest wskazana przy chelatacji metali ciężkich, bo przesadna podaż może chwilowo przemieszczać metale i nasilać objawy. U osób z astmą lub SIBO niekiedy pojawia się wzdęcie lub kaszel po nebulizacji GSH. Ciąża i karmienie piersią to obszary, gdzie najpierw wybiera się dietę i sen, bo brakuje solidnych danych interwencyjnych.
Poniżej krótkie porównanie strategii. Zestawienie pomaga dopasować formę do celu i horyzontu czasu.
| Opcja | Kiedy rozważać | Typowe dawki | Uwagi o skuteczności |
|---|---|---|---|
| NAC | Smog, infekcje, niski GSH | 600–1200 mg/d przez 4–12 tyg. | Dobra baza, wspiera syntezę GSH |
| GSH liposomalny | Szybszy efekt, wrażliwy żołądek | 100–500 mg/d przez 6–8 tyg. | Lepsza biodostępność niż kapsułki |
| S-acetyl-L-glutathione | Niska tolerancja NAC, zmęczenie | 100–300 mg/d rano | Stabilna forma, łagodny profil |
| Selen + ALA | Niska podaż selenu w diecie | 55–100 µg + 100–300 mg/d | Wspiera enzymy i regenerację GSH |
Jeśli po 6–8 tygodniach brak zmian w samopoczuciu lub wynikach badań, strategię lepiej zmienić niż podnosić dawki. Zawsze opłaca się równolegle zadbać o sen, białko i ekspozycję na stresory chemiczne, bo to stabilizuje efekty suplementów.
Jak stres, sen i trening wpływają na poziom glutationu?
Krótko: stres obniża glutation, a dobry sen i dobrze dobrany trening pomagają go odbudować. Różnice potrafią być zauważalne już po kilku dniach zmiany rutyny, choć stabilny efekt zwykle pojawia się po 2–4 tygodniach.
Przewlekły stres podnosi poziom kortyzolu, co zwiększa zużycie glutationu w wątrobie i mózgu. U części osób widać to w badaniach jako spadek zredukowanej formy GSH o kilkanaście procent w ciągu kilku tygodni intensywnej presji. Pomaga więc wprowadzenie prostych „buforów” w ciągu dnia. Trzy krótkie pauzy od ekranu po 5 minut, łącznie 15 minut spokojnego oddechu (np. dłuższy wydech) i ekspozycja na naturalne światło rano zmniejszają pobudzenie współczulne, co ogranicza tempo „spalania” glutationu.
Sen działa jak nocny serwis. W 7–9 godzinach regeneracji rośnie aktywność enzymów, które odnawiają glutation (glutation reduktaza). Już przesunięcie pory snu o 60 minut wcześniej i trzymanie stałej pobudki przez 10–14 dni poprawia subiektywną energię i często normalizuje poranny poziom GSH/GSSG (stosunek formy zredukowanej do utlenionej). Na sen szczególnie źle działa połączenie alkoholu i niebieskiego światła wieczorem. Ograniczenie ekranów w ostatnich 90 minutach i chłodniejsze, zaciemnione pomieszczenie obniżają liczbę przebudzeń, co sprzyja odnowie antyoksydacyjnej.
- Trening umiarkowany 3–5 razy w tygodniu po 30–45 minut podnosi aktywność enzymów związanych z glutationem.
- Bardzo intensywne interwały dzień po dniu mogą chwilowo obniżać GSH i nasilać stres oksydacyjny.
- Dodanie 1 dnia pełnego odpoczynku lub lekkiego spaceru po mocnym treningu przyspiesza odbudowę zapasów.
- Nawodnienie na poziomie ok. 30 ml/kg masy ciała dziennie ułatwia pracę wątroby, gdzie glutation jest intensywnie wykorzystywany.
- Posiłek z białkiem (20–30 g) do 60 minut po wysiłku dostarcza cysteiny, kluczowego „klocka” do syntezy GSH.
Dobrze ułożony ruch działa jak szczepionka przeciw stresowi: bodziec jest kontrolowany, a układ antyoksydacyjny adaptuje się, podnosząc bazowy poziom glutationu w kolejnych tygodniach. Gdy brakuje snu lub treningi są zbyt ciężkie i zbyt częste, krzywa się odwraca i pojawia się wrażliwość na infekcje czy „mgła” po południu. Prosty test praktyczny? Jeśli tętno spoczynkowe rośnie o 5–7 uderzeń przez 3 dni z rzędu, plan pomaga złagodzić o 1 sesję i położyć nacisk na sen, bo to właśnie on domyka cykl odbudowy glutationu.
Czy glutation pomaga w detoksykacji wątroby i poprawie odporności?
Krótka odpowiedź brzmi: tak, glutation pomaga zarówno w detoksykacji wątroby, jak i w regulacji odporności. Działa jak wewnętrzny „kurier” – przyłącza do siebie reaktywne związki i prowadzi je do bezpiecznego usunięcia, a jednocześnie ustawia właściwe „napięcie” układu immunologicznego, by reagował skutecznie, lecz bez przesady.
W wątrobie glutation wspiera tzw. sprzęganie toksyn w II fazie detoksykacji. Dzięki temu pestycydy, metabolity leków i aldehydy po alkoholu stają się rozpuszczalne w wodzie i mogą zostać wydalone z żółcią lub moczem. Gdy jego poziom spada, rośnie stres oksydacyjny hepatocytów, co objawia się podwyższoną aktywnością ALT/AST i gorszą tolerancją leków. W badaniach obserwowano, że podniesienie zasobów glutationu w ciągu 2–4 tygodni poprawia markery oksydacji lipidów i sprzyja szybszej regeneracji po ekspozycji na toksyny środowiskowe.
Odporność także korzysta na wysokim stosunku GSH:GSSG (forma zredukowana do utlenionej). Ten „wskaźnik czerwoności” środowiska komórkowego pomaga limfocytom T różnicować się do komórek efektorowych, a makrofagom skutecznie „sprzątać” patogeny. Zbyt niski poziom glutationu osłabia działanie limfocytów NK i sprzyja przewlekłemu stanowi zapalnemu o niskim nasileniu. W praktyce objawia się to częstszymi infekcjami w sezonie jesienno-zimowym oraz wolniejszym powrotem do formy po chorobie o 2–3 dni.
Co ciekawe, glutation nie „podbija” odporności w sposób bezrefleksyjny. Raczej wyrównuje jej pracę, ograniczając nadmierną produkcję cytokin prozapalnych przy jednoczesnym wsparciu odpowiedzi przeciwbakteryjnej i przeciwwirusowej. Dlatego osoby z dużą ekspozycją na dym tytoniowy lub intensywny wysiłek (np. dwa mocne treningi pod rząd) często czują różnicę, gdy organizm szybciej „czyści” wysiłkowe wolne rodniki, a gardło przestaje drapać po 24–48 godzinach zamiast ciągnąć się cały tydzień.
Jak bezpiecznie monitorować efekty i łączyć glutation z innymi antyoksydantami?
Najbezpieczniej zaczynać od małych kroków i systematycznej obserwacji. Glutation działa w tle, dlatego pierwsze efekty pojawiają się subtelnie: poprawa energii w ciągu dnia, lżejsze trawienie, spokojniejszy sen. Zwykle daje się to wyłapać w ciągu 2–4 tygodni. Jeśli pojawia się ból głowy, mdłości albo wysypka, bywa to sygnał zbyt szybkiej „detoksykacji” lub interakcji z innymi suplementami i wtedy opłaca się zwolnić tempo.
Monitorowanie efektów pomaga oprzeć się na danych, a nie tylko na intuicji. Prosty dziennik objawów z 3–5 parametrami, jak energia 1–10, jakość snu, regularność wypróżnień i skóra, pokazuje trend już po 14 dniach. Od strony badań laboratoryjnych przydają się markery stresu oksydacyjnego (np. 8‑OHdG w moczu) i enzymy wątrobowe (ALT, AST), sprawdzane co 8–12 tygodni. U osób z chorobami przewlekłymi sens ma też homocysteina, która bywa wrażliwa na wsparcie układu antyoksydacyjnego.
Łączenie glutationu z innymi antyoksydantami przypomina dobrze skomponowany zespół: każdy gra swoją partię. Witamina C pomaga regenerować glutation w komórkach, alfa‑liponowy (ALA) wspiera recykling innych przeciwutleniaczy, a selen jest kofaktorem dla peroksydazy glutationowej (enzymu, który „używa” glutationu). Umiar jest kluczowy. Zbyt wysokie dawki wielu antyoksydantów naraz mogą paradoksalnie osłabiać sygnały adaptacyjne organizmu, zwłaszcza jeśli trening jest częsty i intensywny.
Poniżej kilka prostych reguł, które porządkują plan i ułatwiają obserwację.
- Zacząć od jednego dodatku na raz i utrzymać go 10–14 dni, zanim dołączy się kolejny. Ułatwia to wychwycenie, co naprawdę działa.
- Witamina C 250–500 mg dziennie często wystarcza jako „partner” regenerujący glutation. Wyższe dawki lepiej dzielić na 2 porcje.
- ALA 100–200 mg dziennie bywa dobrym wsparciem u osób z insulinoopornością; poniżej 18:00 u wrażliwych na pobudzenie.
- Selen 55–100 μg dziennie najlepiej w formie selenometioniny. Przy diecie bogatej w orzechy brazylijskie łatwo o nadmiar.
- Koenzym Q10 50–100 mg dziennie może poprawiać tolerancję wysiłku; sens sprawdzić u osób po 40. roku życia.
- Przerwa oceniająca co 8 tygodni (tydzień bez nowych dodatków) pozwala upewnić się, że efekt się utrzymuje, a nie wynika z zbiegu okoliczności.
Takie podejście sprzyja przejrzystości i bezpieczeństwu. W razie stałych leków lub ciąży lepiej skonsultować plan z lekarzem, bo ALA, wysokie dawki witaminy C czy selen mogą wchodzić w interakcje, a korekta dawkowania bywa wtedy konieczna.

 by
by 

